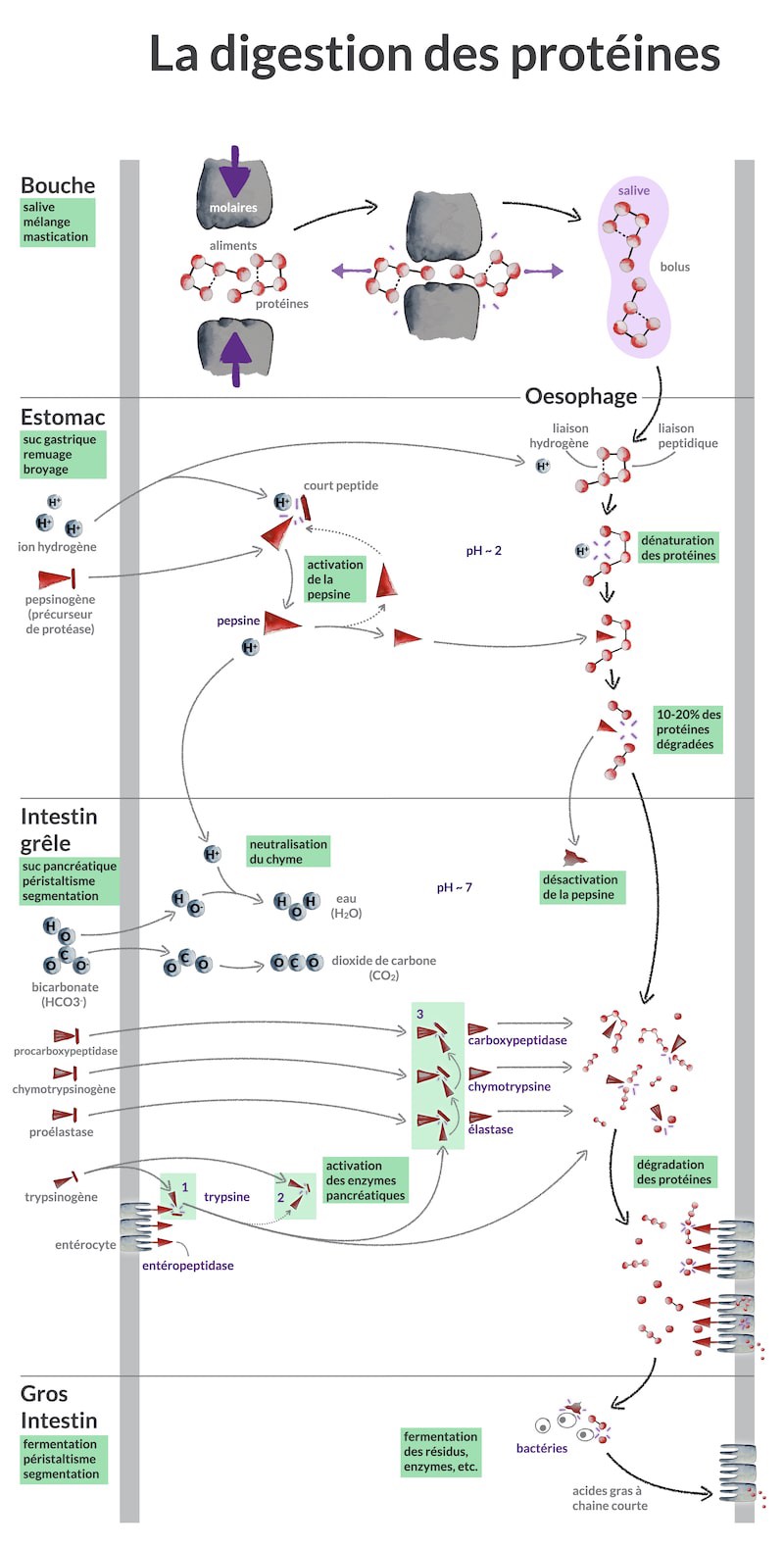
La digestion des protéines. Un résumé visuel avec références scientifiques

Cet article fait partie de mon projet sur le Système Digestif.
Comment se déroule la digestion des protéines dans le corps humain ? Dans cet article, j’intègre des éléments visuels au texte pour expliquer comment les protéines sont digérées tout au long de votre tube digestif, de la bouche à l’anus.
Les protéines sont des chaînes de centaines ou de milliers d’acides aminés  liés les uns aux autres par des liaisons fortes, appelées liaisons peptidiques1
liés les uns aux autres par des liaisons fortes, appelées liaisons peptidiques1  . Les chaînes plus courtes d’acides aminés sont appelées polypeptides. Et les chaînes très courtes sont appelées dipeptides
. Les chaînes plus courtes d’acides aminés sont appelées polypeptides. Et les chaînes très courtes sont appelées dipeptides  , tripeptides
, tripeptides  , etc.1.
, etc.1.
Notre intestin n’est capable d’absorber que de petites molécules : acides aminés, di- et tripeptides. Notre système digestif doit donc trouver le moyen de briser toutes ces liaisons pour que les acides aminés puissent être séparés les uns des autres.
Alors, comment se déroule le processus de digestion des protéines, étape par étape ?
Découvrons-le en suivant le destin d’une petite protéine de 5 acides aminés  que, disons, vous venez de dévorer goulûment.
que, disons, vous venez de dévorer goulûment.
Sommaire
- La digestion des protéines commence dans la bouche
- La digestion des protéines dans l’estomac
- La digestion des protéines dans l’intestin grêle
- La fermentation des protéines dans le gros intestin
- Résumé
- Synthèse visuelle
- Discussion sur la science, la digestion et la santé
- Ressources
- Licence libre
- Références
La digestion des protéines commence dans la bouche
Dès que cette protéine et ses amis nutriments entrent dans votre bouche, vous commencez à les mâcher.
Vous mordez avec vos incisives, vous écrasez avec vos molaires, et vous mélangez les particules d’aliments et la salive avec votre langue. Cette mastication et ce mélange, cette forte dégradation mécanique, est la première étape de la digestion des protéines2.
Mais cette dégradation mécanique n’affecte pas la structure moléculaire des protéines.
Elle ne brise pas les liaisons peptidiques1  , les liaisons fortes entre les acides aminés
, les liaisons fortes entre les acides aminés  , qui créent la chaîne d’acides aminés
, qui créent la chaîne d’acides aminés  appelée la structure primaire de la protéine.
appelée la structure primaire de la protéine.
Elle ne brise pas non plus les liaisons plus faibles, comme les liaisons hydrogène1  , qui maintiennent la chaîne protéique repliée en structures 3D secondaires et même tertiaires
, qui maintiennent la chaîne protéique repliée en structures 3D secondaires et même tertiaires  .
.
Alors, si la structure des protéines n’est pas affectée par la mastication et le remuage, pourquoi dit-on que la digestion des protéines commence dans la bouche ?
Parce que lorsque les fragments alimentaires sont petits et enrobés de salive  , ils sont facilement entraînés par votre œsophage, votre estomac les traite plus efficacement et leur surface en contact avec les enzymes est beaucoup plus grande2.
, ils sont facilement entraînés par votre œsophage, votre estomac les traite plus efficacement et leur surface en contact avec les enzymes est beaucoup plus grande2.
La mastication des protéines est donc une étape importante qui prépare le processus de digestion chimique qui aura lieu plus tard dans l’estomac et l’intestin grêle. En revanche, les gros morceaux de protéines enchevêtrées, dont les liaisons peptidiques sont difficiles à atteindre par les enzymes, sont plus difficiles à digérer.
Il se trouve que la salive contient des protéases, c’est-à-dire des enzymes qui dégradent les protéines. Mais ces protéases, appelées kallikréines, ne sont pas directement impliquées dans le processus de digestion des protéines. Elles jouent plutôt un rôle dans la régulation du flux sanguin dans les glandes salivaires2.
Finalement, cette action mécanique de mastication avec les dents et de remuage avec la langue crée un mélange appelé bolus, que vous propulsez dans l’œsophage quand vous avalez.
La digestion des protéines dans l’estomac
Mais avant même que vous n’avaliez, votre estomac prépare déjà avec assiduité l’étape suivante.
Les parois de l’estomac contiennent de petites cavités renfermant les glandes gastriques. Cachées dans ces cavités se trouvent des cellules, les cellules pariétales2–4, qui sécrètent le suc gastrique.
Entre autres composants, ce suc contient des ions hydrogène  et des ions chlorure
et des ions chlorure  , c’est-à-dire de l’acide chlorhydrique. Oui, vous avez vraiment de l’acide chlorhydrique dans votre estomac ! La libération de ce suc gastrique très acide renforce l’acidité de l’estomac jusqu’à environ pH 23,5.
, c’est-à-dire de l’acide chlorhydrique. Oui, vous avez vraiment de l’acide chlorhydrique dans votre estomac ! La libération de ce suc gastrique très acide renforce l’acidité de l’estomac jusqu’à environ pH 23,5.
Lorsque le bolus que vous avez propulsé dans votre œsophage atterrit dans l’estomac, il découvre une étrange caverne dont les parois se contractent lentement en vagues se déplaçant de haut en bas. Ces vagues de contraction, appelées péristaltisme, se déplacent à une vitesse d’environ 1 cm par seconde2.
Au sommet de l’estomac, l’onde de contraction remue le contenu de l’estomac. Elle mélange le bolus avec le suc gastrique, créant une potion appelée chyme, où les ions hydrogène et les enzymes se diffusent uniformément autour des protéines2.
Étant maintenant immergée dans le chyme, sous une si forte acidité, notre petite protéine commence à se dénaturer, c’est-à-dire qu’elle commence à perdre sa structure 3D  .
Cela est dû au fait que l’acidité perturbe les faibles liaisons hydrogène
.
Cela est dû au fait que l’acidité perturbe les faibles liaisons hydrogène  qui maintiennent la protéine repliée1.
qui maintiennent la protéine repliée1.
À ce stade, cependant, les chaînes d’acides aminés sont encore intactes, car le pH ne brise pas les solides liaisons peptidiques  entre les acides aminés (la plupart du temps)1.
entre les acides aminés (la plupart du temps)1.
Mais, cette altération des protéines les rend déjà beaucoup plus vulnérables aux attaques des protéases  !
!
Justement, dans les petites glandes gastriques, un autre type de cellules, les cellules principales, ont également ajouté au suc gastrique un précurseur d’une protéase, le pepsinogène  .
En circulant dans l’estomac, en étant mélangé au chyme acide, le pepsinogène subit une transformation.
En effet, étant également une protéine, sa structure 3D est sensible au pH.
.
En circulant dans l’estomac, en étant mélangé au chyme acide, le pepsinogène subit une transformation.
En effet, étant également une protéine, sa structure 3D est sensible au pH.
En présence d’ions hydrogène  , dès que le pH est inférieur à 6, le pepsinogène
, dès que le pH est inférieur à 6, le pepsinogène  perd une courte série d’acides aminés
perd une courte série d’acides aminés  et devient la protéase active pepsine
et devient la protéase active pepsine  .
.
Fait intéressant, une fois que la pepsine est activée, elle agit aussi comme un autocatalyseur, un accélérateur, sur la conversion du pepsinogène2,5 ! Ce qui conduit à un taux d’activation de la pepsine encore plus rapide !
La pepsine commence à briser les liaisons peptidiques entre les acides aminés2,6  , créant des polypeptides de plus en plus petits
, créant des polypeptides de plus en plus petits  ,
,  …
…
Globalement, dans le processus de digestion, la pepsine représente 10 à 20 % de la dégradation des protéines2,3.
Alors que le chyme est en train d’être remué en haut de l’estomac, alors que notre petite protéine perd sa forme 3D et commence même à se briser, perdant certaines de ses liaisons peptidiques, la vague de contraction atteint le bas de l’estomac.
Dans sa partie inférieure, votre estomac est plus étroit, avec des parois musculaires plus épaisses. Par conséquent, l’onde de contraction commence à avoir un effet de broyage de plus en plus fort. Cela fragmente, encore plus, les morceaux restants que vous n’avez pas complètement mâchés2.
Finalement, lorsque la vague atteint le fond de l’estomac, une dernière contraction forte libère un petit jet de chyme dans l’intestin grêle tout en repoussant le reste du chyme vers l’arrière pour continuer le remuage et le broyage2,3.
En libérant ainsi le chyme, petit à petit, à un rythme régulier, l’estomac joue un rôle très important. Même si, en proie à une fringale, vous avez englouti votre repas en quelques minutes seulement, votre estomac dévoué accepte tout avec compassion, ralentit ce tsunami de nourriture, protégeant ainsi vos organes digestifs suivants, délicats et bien occupés, afin qu’ils aient le temps de tout traiter correctement.
Mais, si la pepsine ne représente que 10 à 20 % de la digestion des protéines, qui va terminer le travail ?
La digestion des protéines dans l’intestin grêle
Pendant que votre estomac est occupé à sécréter, mélanger, broyer, le pancréas prépare déjà assidûment l’étape suivante.
Dans le pancréas, certaines cellules, appelées cellules acineuses, sécrètent 4 enzymes protéolytiques principales - les protéases pancréatiques - dans un mélange appelé le suc pancréatique4.
Comme pour la pepsine dans l’estomac, ces 4 protéases pancréatiques sont sécrétées sous forme de précurseurs inactifs3,6 : trypsinogène  , chymotrypsinogène
, chymotrypsinogène  , proélastase
, proélastase  , et procarboxypeptidase
, et procarboxypeptidase  .
.
Alors que ce suc digestif, rempli de précurseurs d’enzymes, commence à circuler dans le canal pancréatique en direction de l’intestin, d’autres cellules du canal pancréatique, ajoutent au mélange une forte concentration de bicarbonate (HCO3-)3,4  , jusqu’à ce que le suc pancréatique atteigne un pH d’environ 7,5-87.
, jusqu’à ce que le suc pancréatique atteigne un pH d’environ 7,5-87.
Au moment où le chyme, projeté par votre estomac, se déverse dans le premier segment de votre intestin grêle - le duodénum -, avec des protéines et des polypeptides partiellement digérés, le suc pancréatique est prêt à entrer en scène. D’abord, ce suc pancréatique alcalin neutralise rapidement le chyme acide, l’empêchant d’endommager la paroi de l’intestin3.
Ensuite, l’enzyme pepsine  devient inactive. En effet, comme nous l’avons vu dans l’estomac, la pepsine est une protéine, sa forme est donc sensible au pH. Alors que l’alcalinité augmente, l’activité de la pepsine cesse à pH 5, et au moment où le pH atteint 6,5, notre pauvre enzyme commence même à se dénaturer8
devient inactive. En effet, comme nous l’avons vu dans l’estomac, la pepsine est une protéine, sa forme est donc sensible au pH. Alors que l’alcalinité augmente, l’activité de la pepsine cesse à pH 5, et au moment où le pH atteint 6,5, notre pauvre enzyme commence même à se dénaturer8  . Elle finira digérée comme les autres protéines.
. Elle finira digérée comme les autres protéines.
Dans ce nouvel environnement plus alcalin, les enzymes pancréatiques sont sur le point de prendre en charge le travail de digestion des protéines. Ces protéases étant beaucoup plus puissantes que la pepsine, la majeure partie de la digestion des protéines se fait ici, dans le duodénum et le jéjunum supérieur3, les deux premiers segments de l’intestin grêle.
Mais, vous rappelez-vous, qu’à ce stade, les enzymes pancréatiques sont encore inactives ? Leur activation a lieu lors d’un processus un peu complexe et assez intéressant ! Voyons comment…
Comme je l’ai également décrit dans l’article sur l’aire du tube digestif, la paroi interne de l’intestin est repliée en de très petites structures en forme de doigts appelées villosités. Cette multitude de villosités sur la paroi de l’intestin ressemble à une brosse lisse, d’où son nom - la bordure en brosse2.
Ces villosités sont recouvertes de cellules épithéliales, les entérocytes, dont la membrane se replie en structures en forme de doigts encore plus petits appelés microvillosités  .
.
Parmi de nombreuses fonctions, comme l’absorption des nutriments, la bordure en brosse joue également un rôle dans la digestion.
Les entérocytes du duodénum et du jéjunum sécrètent différents types de protéases - entéropeptidases  - aussi appelées entérokinases. Ces drôles d’enzymes ne sont pas libérées dans la lumière de l’intestin grêle. Au contraire, elles restent ancrées aux microvillosités de la membrane des entérocytes
- aussi appelées entérokinases. Ces drôles d’enzymes ne sont pas libérées dans la lumière de l’intestin grêle. Au contraire, elles restent ancrées aux microvillosités de la membrane des entérocytes  3.
3.
Et voilà : ces drôles d’enzymes ancrées à notre paroi intestinale sont les surprenantes activatrices de nos enzymes pancréatiques !
Dès que les enzymes pancréatiques atterrissent dans le duodénum, dès qu’elles entrent en contact avec les entéropeptidases, elles commencent à s’activer.
Tout d’abord, les entéropeptidases donnent le coup d’envoi de l’activation en convertissant le trypsinogène  en trypsine
en trypsine  en retirant un court peptide3,6
en retirant un court peptide3,6  .
Deuxièmement, la trypsine elle-même aide à convertir le trypsinogène en trypsine !6
Troisièmement, la trypsine transforme : le chymotrypsinogène
.
Deuxièmement, la trypsine elle-même aide à convertir le trypsinogène en trypsine !6
Troisièmement, la trypsine transforme : le chymotrypsinogène  en chymotrypsine
en chymotrypsine  , proélastase
, proélastase  en élastase
en élastase  , et procarboxypeptidase
, et procarboxypeptidase  en carboxypeptidase3,6
en carboxypeptidase3,6 !
!
Merveilleux !
Une fois activées, la trypsine, la chymotrypsine et l’élastase se pressent pour dégrader les protéines et polypeptides restants, en chaînes polypeptidiques encore plus petites de 2  à 6
à 6  acides aminés3.
acides aminés3.
La carboxypeptidase décompose encore certains de ces petits polypeptides en acides aminés individuels3  .
.
Enfin, les entéropeptidases, nos enzymes ancrées aux parois intestinales, décomposent les petits peptides en tripeptides  , en dipeptides
, en dipeptides  , et en acides aminés
, et en acides aminés  3.
3.
Mais, tout comme dans l’estomac, le processus de digestion dans l’intestin grêle n’est pas seulement un mécanisme chimique. Il est également mécanique. Pendant que toutes les réactions chimiques se produisent, l’intestin s’amuse à se contracter de deux façons : le péristaltisme et la segmentation.
Comme dans l’estomac, des vagues de contraction propulsent le chyme le long de l’intestin grêle2. C’est ce qu’on appelle le péristaltisme.
Parfois, l’intestin grêle se contracte en différents points et maintient sa contraction pendant un certain temps avant de se détendre et de se contracter à nouveau sur les segments adjacents2. C’est ce qu’on appelle la segmentation.
Le péristaltisme et la segmentation dans l’intestin grêle ont plusieurs fonctions2. Ils mélangent le chyme acide provenant de l’estomac avec le suc pancréatique alcalin, ils facilitent le mélange des particules alimentaires avec les enzymes pancréatiques, et ils aident à l’absorption des acides aminés.
Après cette avalanche d’activations et de dégradations, la plupart des protéines ont été digérées à ce stade. L’absorption a déjà lieu dans le duodénum et se poursuit dans les segments suivants de l’intestin grêle : le jéjunum et l’iléon.
Il est intéressant de noter que les entérocytes peuvent absorber non seulement les acides aminés mais aussi les di- et tripeptides3. En fait, les protéines digérées sont principalement absorbées sous forme de di- et tripeptides3,6. Ces peptides sont ensuite décomposés en acides aminés, à l’intérieur même des entérocytes, avant d’être libérés dans le sang3,6.
La fermentation des protéines dans le gros intestin
Malgré le processus de digestion des protéines qui a commencé dans la bouche, s’est poursuivi dans l’estomac et s’est surtout déroulé dans l’intestin grêle, certaines protéines parviennent encore au gros intestin sans avoir été totalement digérées3,4.
Ces protéines peuvent provenir des aliments, comme l’élastine et le collagène, ou du tube digestif lui-même, comme les cellules épithéliales mortes, les bactéries mortes ou les enzymes pancréatiques, qui sont également des protéines4.
Après être arrivées dans le gros intestin, ces protéines sont décomposées par les bactéries du côlon4. Cette dégradation conduit à la formation de molécules utiles pour notre organisme, comme les acides gras à chaîne courte et à chaîne ramifiée.
Les cellules épithéliales du côlon absorbent ces acides gras4. Dans l’organisme, ils sont utilisés comme nutriments, et certains d’entre eux sont utilisés localement comme source d’énergie par les cellules épithéliales du côlon.
Résumé
Les protéines sont des chaînes d’acides aminés repliées en structures 3D  . La structure des protéines est maintenue grâce à différents types de liaisons, principalement des liaisons peptidiques
. La structure des protéines est maintenue grâce à différents types de liaisons, principalement des liaisons peptidiques  , et des liaisons hydrogènes
, et des liaisons hydrogènes  . Le processus de digestion brise ces liaisons, transformant les grosses protéines en acides aminés libres
. Le processus de digestion brise ces liaisons, transformant les grosses protéines en acides aminés libres  .
.
Bien que certaines protéases soient sécrétées dans la salive, elles n’agissent pas dans la digestion des protéines. Pourtant, la digestion commence dans la bouche, avec une forte action mécanique de mastication et de mélange. Les aliments bien mâchés facilitent considérablement la digestion chimique des protéines dans l’estomac.
En combinant un pH très bas, la pepsine, une enzyme protéique, et le remuage, l’estomac lance efficacement le processus chimique de digestion des protéines. Pourtant, seuls 10 à 20 % de la digestion des protéines ont lieu dans l’estomac lui-même, laissant la majeure partie du travail de dégradation des protéines à l’intestin grêle…
La majeure partie du processus de digestion des protéines se déroule au début de l’intestin grêle, dans le duodénum et dans la partie supérieure du jéjunum. Les protéines partiellement digérées par l’estomac y sont dégradées par plusieurs protéases pancréatiques puissantes et par des enzymes accrochées à la membrane des cellules épithéliales intestinales. Le processus de digestion des protéines se termine à l’intérieur de ces cellules épithéliales.
Certaines protéines provenant de l’alimentation ou du tube digestif atteignent le gros intestin sans être digérées. Là, elles sont principalement transformées en acides gras à chaîne courte par la fermentation des bactéries du côlon, et absorbées par les cellules épithéliales.
Discussion sur la science, la digestion et la santé
Cet article se concentre sur les principaux mécanismes de la digestion normale des protéines, tels qu’ils sont décrits dans les manuels scientifiques. Vous pouvez trouver des informations plus détaillées dans les manuels eux-mêmes.
Je pense qu’il peut aussi être utile d’ajouter quelques réflexions supplémentaires sur la digestion des protéines et la santé, pour donner une vue d’ensemble.
Facteurs antinutritionnels
Certains aliments peuvent perturber ce processus de digestion idéal. Par exemple, certaines sources de protéines végétales, comme les légumineuses, contiennent des antinutriments, comme les inhibiteurs de la trypsine. Comme vous l’avez vu, la trypsine est une enzyme protéique cruciale dans l’intestin grêle, de sorte que son inhibition peut avoir un impact significatif sur la digestion des protéines. Le trempage, la cuisson et la fermentation des légumineuses peuvent réduire la teneur en antinutriments, augmentant ainsi leur digestibilité. Par exemple, j’ai étudié dans un autre article comment les inhibiteurs de trypsine dans les pois chiches peuvent être réduits de ~90% en préparant du tempé de pois chiches.
Et aussi : l’absorption, la conversion, la distribution des nutriments…
Lorsqu’on essaie d’améliorer notre santé grâce à l’alimentation, on a facilement tendance à se concentrer sur les apports quotidiens en protéines ou en autres nutriments. Pourtant, une fois dans notre ventre, les aliments doivent encore être digérés correctement, les nutriments doivent être absorbés par la paroi intestinale, convertis et stockés correctement dans le foie, et délivrés efficacement à l’intérieur des bonnes cellules au bon moment. Toutes ces étapes peuvent potentiellement être perturbées et contribuer au développement de problèmes de santé. Du coup, même si le processus de digestion des protéines et des autres nutriments est très intéressant et important, si l’on veut comprendre la nutrition et faire des choix appropriés pour sa santé, il faut creuser davantage.
Les connaissances scientifiques sont sans doute très limitées
Quand on voit le résumé visuel ci-dessus, rien que pour la digestion des protéines, avec tant de flèches et d’enzymes partout, cela paraît déjà bien complexe ! Alors, on a facilement tendance, inconsciemment, à penser que ces informations scientifiques sont déjà exhaustives et précises. Pourtant, plus on creuse, plus on se rend compte qu’il y a probablement de nombreuses erreurs, des enzymes inconnues, des mécanismes inconnus, etc. Surtout pour des sujets très complexes comme la nutrition, la santé, l’agronomie ou l’écologie.
Pour prendre un exemple simple, lorsque j’ai fait des recherches sur la longueur de notre tube digestif, j’ai remarqué qu’un manuel publié en 2018 indiquait encore une longueur deux fois supérieure pour l’intestin grêle que l’estimation la plus récente publiée quatre ans plus tôt en 2014. Parfois, même des chercheurs et des professeurs intelligents oublient de vérifier les informations les plus fondamentales, pensant que, puisque tout le monde les répète depuis des décennies, elles doivent être exactes.
Très souvent, si on essaie de chercher l’origine de certains conseils nutritionnels ou de santé courants, fournis par la médecine conventionnelle ou alternative, on se rend compte qu’ils sont basés sur des hypothèses et des théories qui n’ont pas vraiment été prouvées. Pourtant, on pense spontanément que, si c’est conseillé, cela doit avoir été prouvé et vérifié de nombreuses fois.
Je pense que les connaissances scientifiques peuvent être très intéressantes et utiles, et je m’amuse bien à m’y plonger. Mais plus je plonge, plus je constate que les sociétés occidentales ont tendance à voir dans la connaissance scientifique beaucoup plus de certitudes que ce qu’elle est réellement capable d’offrir ! Avoir conscience de cela, c’est déjà être beaucoup plus armé et armée pour affronter la complexité du monde.
Bonnes ressources
Si vous souhaitez vous plonger plus profondément dans les voies métaboliques qui sous-tendent la sécrétion des sucs gastriques et pancréatiques et la digestion des protéines, je vous recommande de jeter un coup d’œil au site
Kyoto Encyclopedia of Genes and Genomes .
Il propose une carte bien fournie des voies métaboliques ainsi que d’autres informations détaillées lorsque vous cliquez sur les différentes molécules.
.
Il propose une carte bien fournie des voies métaboliques ainsi que d’autres informations détaillées lorsque vous cliquez sur les différentes molécules.
Vous avez apprécié cet article ?
Génial ! Alors, vous aimerez peut-être ces résumés visuels de la longueur du tube digestif, et de l’aire du tube digestif.
Licence libre
Le texte, les images et la synthèse visuelle sont sous licence libre, ce qui signifie que vous êtes libre de partager les adaptations, même à des fins commerciales ! Pourvu que vous créditiez mon travail en mentionnant “Elegant Experiments” avec un lien vers www.elegantexperiments.net